Ковалентная связь – что это такое, какими характеристиками обладает
Само словосочетание использует в названии 2 латинских слова: «со», что означает «вместе», «совместно» и «vales» — владеющий силой. Из этимологии термина можем сделать вывод, что ковалентную связь образует пара электронов, которые в то же время относятся к обоим атомам. Проще говоря, между такими атомами возникает связь благодаря двум общим электронам. Причем такая связь характерна только для атомов неметаллов, может возникать как в атомах кристаллов, так и в атомах молекул.
Обнаружил ковалентную связь в начале 20 столетия американский ученый-химик Дж. Льюис. Изначально существование подобной связи было лишь гипотезой и мыслью, а уж потом эксперименты и тесты ее подтвердили. И что же удалось выявить ученым? Оказалось, что электроотрицательность, свойственная для неметаллов, может быть усиленной при взаимодействии 2 атомов. При этом передача электронов межу ними может и не произойти, и тогда эти электронных объединяться в эту самую ковалентную связь.
Какие существуют виды ковалентной связи
Так, определено 2 таких вида: донорно-акцептный и обменный.
Последний предполагает, что каждый из атомов, который соединяется, отдает на создание этой ковалентной связи по 1 неспаренному электрону. При этом у последних должны находиться противоположные заряды. Пример такой связи можно рассмотреть у молекулы водорода. Так, когда его атомы начинают двигаться навстречу друг к другу, их электронные облака сливаются (происходит их так званое «перекрывание»). В результате электронная плотность между самими ядрами возрастают, они усиленно притягиваются навстречу, а сама энергетическая система идет на спад. И все же, если ядра приближаются друг к другу слишком близко, то затем начинают отталкиваться до момента образования оптимального расстояния.
Другой вид связи, донорно-акцепторный, возникает в случае, когда одна из частиц, выступающая донором, «выдает» для образования этой связи электронную пару, а вторая, которая является акцептором, необходимую для этого свободную орбиталь.
Также можно отметить другие типы ковалентной связи: неполярную и полярную, о которых пойдет речь ниже.
Неполярный тип
Пример возникновения связи неполярного типа изображен на схеме. Очевидно, что возникает она между одинаковыми атомами.
Так, в молекулах общие пары электроном равноудалены от ядер атомов. Рассмотреть ситуацию можно на примере кислорода. В его молекуле (как показано на схеме) атомы имеют 8-ми электронную «настройку», а также 4 общие пары электронов.
К материалам, которые образуют неполярный тип ковалентной связи, можно отнести жидкости, газы, а также твердые вещества с низкой плавкостью.
Полярный тип
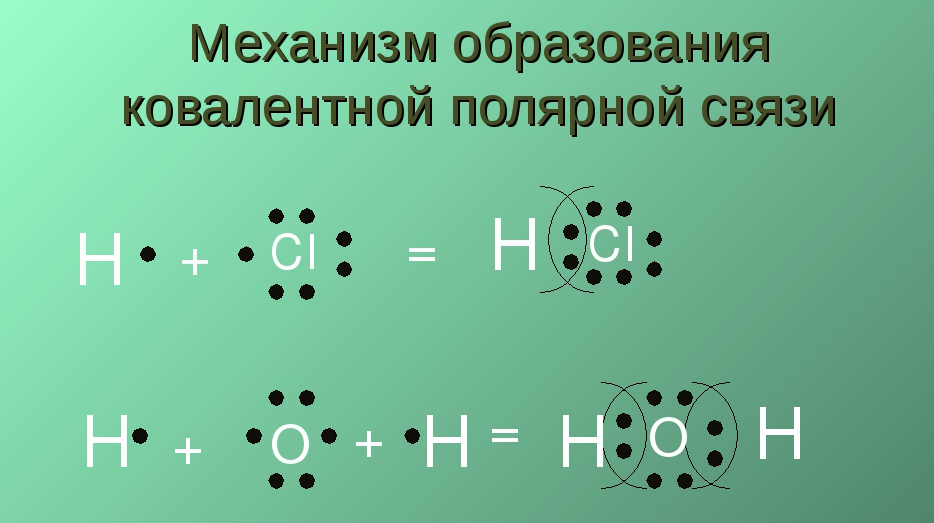
Этот вид ковалентной связи возникает, когда таким образом соединенные атомы разные по своей электроотрицательности. При этом поступившие во связь электроны в равной степени не относятся к 2 атомам. Отметим, что значительную часть времени во связи такие электроны пребывают в близости к одному из атомов.
Пример полярного типа можно рассмотреть на молекуле хлороводорода. Итак, электроны, участвующие в создании связи, приближаются меньше к атому водорода, и больше к хлору. Это обусловлено тем, что у последнего существенно выше электроотрицательность.
В быту пример ковалентной связи полярного типа можно проследить на воде.
Как выявляется ковалентная связь
Зная, как именно она образуется, и какие типы бывают, достаточно лишь узнать химическую формулу исследуемой молекулы и ее свойства. Так, если в молекулу входят атомы различных элементов, то возникающую связь можно считать полярной, если же одного, то неполярной.
Еще один важный вывод по этой теме таков, что ковалентные связи в основном образуются у неметаллов, что аргументировано самой природой создания таких связей.
